國家藥品監(jiān)督管理局藥品審評中心(CDE)于2025年7月4日發(fā)布《關于公開征求藥品電子通用技術文檔(eCTD)相關技術文件和申報資料目錄層級對應表意見的通知》,標志著中國eCTD技術標準迎來首次技術層面的全面修訂。北京康茂峰科技有限公司eCTD電子提交業(yè)務負責人Richard迅速響應,通過“康茂峰醫(yī)學翻譯”視頻號對此次更新進行專業(yè)解讀,助力行業(yè)及時把握政策動向。
《關于公開征求藥品電子通用技術文檔(eCTD)相關技術文件和申報資料目錄層級對應表意見的通知》
與時俱進:與國際最新標準與現(xiàn)行實操接軌
Richard在視頻中指出,本次修訂以“與時俱進”為主基調,核心變化包括:
1、徹底告別紙質要求:刪除所有與紙質資料相關的條款,將“紙質遞交”統(tǒng)一調整為“非eCTD方式遞交”,與當前電子申報實際流程同步。 

實施指南 v1.1 (修訂版征求意見稿)中目錄刪除章節(jié)2.8 紙質資料的遞交及要求


實施指南 v1.1 (修訂版征求意見稿)中章節(jié)4.1.2刪除說明函內容中與紙質資料內容相關的部分


實施指南 v1.1 (修訂版征求意見稿)中將敘述中的“紙質遞交”調整為“非eCTD方式提交”
2、國際規(guī)范升級:參考指導原則文件更新至最新版,包括《ICH eCTD文件格式規(guī)范》(1.2→1.3)和《ICH eCTD IWG問題解答和規(guī)范變更要求文件》(1.31→1.33),強化與國際標準接軌。


3、技術細節(jié)優(yōu)化:文件大小限制從500MB壓縮至200MB,與電子申報資料要求一致;新增“網絡傳輸”提交方式,提升操作靈活性;同步更新政務系統(tǒng)名稱及“電子簽章”等術語表述。


eCTD實施指南 v1.1 (修訂版征求意見稿)中將章節(jié)7.6中的單個文件大小從“500 MB”調整為“200 MB”


eCTD驗證標準 v1.1 (修訂版征求意見稿)中將2.2項中的單個文件大小從“500 MB”調整為“200 MB”


eCTD實施指南 v1.1 (修訂版征求意見稿)中2.7章節(jié)提交要求中增添“網絡傳輸”


eCTD實施指南 v1.1 (修訂版征求意見稿)中2.4章節(jié)將“國家藥品監(jiān)督管理局網上辦事大廳藥品業(yè)務應用系統(tǒng)”調整為“國家藥品監(jiān)督管理局政務服務門戶藥品業(yè)務應用系統(tǒng)”。


eCTD技術規(guī)范 v1.1 (修訂版征求意見稿)以及eCTD實施指南 v1.1 (修訂版征求意見稿)將“電子簽名”調整為“電子簽章”,與現(xiàn)行其他法規(guī)一致。
精益求精:技術要求優(yōu)化與范圍再擴展
修訂的另一重點是對技術規(guī)范和適用范圍的精細化調整:
1、電子簽章要求簡化:僅保留1.0說明函、1.2申請表等6類關鍵文件需簽章,大幅減輕企業(yè)負擔。

2、驗證標準升級:將部分與PDF大小、書簽以及超文本鏈接等驗證項的嚴重程度從“警告”提升為“錯誤”,提高PDF文件的質量要求。
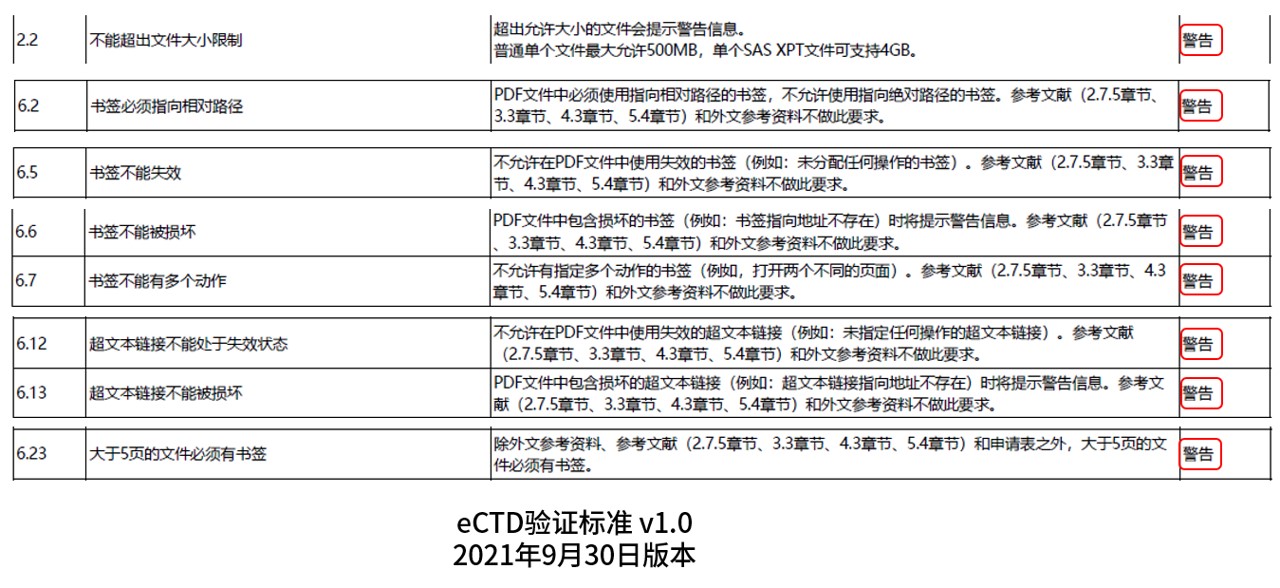
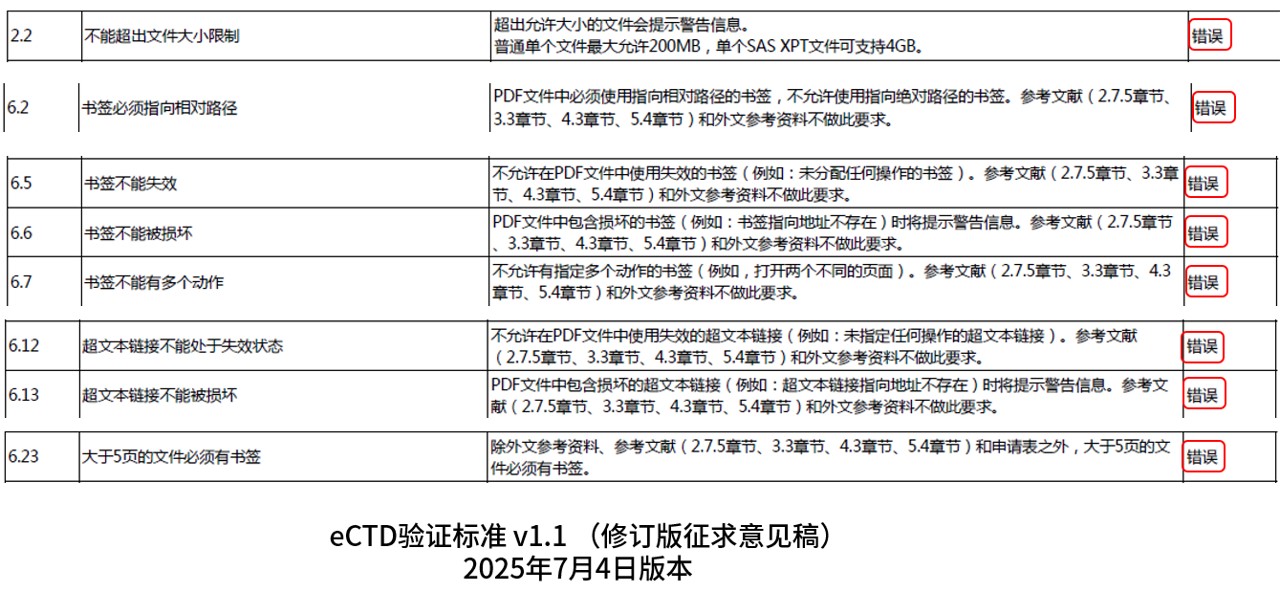
eCTD驗證標準 v1.1 (修訂版征求意見稿)中將8項與PDF相關的驗證項的嚴重程度從“警告”提升到“錯誤”
3、適用范圍擴容:新增原料藥、按生物制品管理的體外診斷試劑上市許可申請、一致性評價等申請的eCTD技術要求,為未來全類別覆蓋鋪路。




